Por Dr. Manuel Guzmán y Dr. Ismael Galve-Roperh

La marihuana y sus preparados se han empleado en medicina desde hace al menos cincuenta siglos. Además, los descubrimientos recientes en el conocimiento del sistema endocannabinoide han contribuido al renacimiento del estudio de sus posibles propiedades terapéuticas, lo que constituye hoy en día un campo de amplio debate científico y clínico.
Con base en la demostración de la función moduladora que los endocannabinoides ejercen sobre numerosas funciones cerebrales, se ha sugerido el potencial terapéutico que la manipulación farmacológica de sus niveles o la administración de agonistas cannabinoides (bien fitocannabinoides, bien cannabinoides sintéticos) podría tener en el tratamiento de diversas patologías que afectan al sistema nervioso.
En algunas de estas enfermedades ya se ha podido poner de manifiesto que existen cambios en la expresión de receptores cannabinoides y/o en los niveles de endocannabinoides en ciertas zonas del cerebro, lo que justificaría el estudio farmacológico de este sistema. Por ejemplo, y de forma general, los cannabinoides ejercen efectos analgésicos que los harían de utilidad en el tratamiento del dolor.
También podrían ser útiles en el tratamiento de los procesos de neuroinflamación, en la que su administración permitiría paliar algunas consecuencias típicas de dichos desórdenes.
Hoy en día sabemos además que, bajo determinadas circunstancias, los cannabinoides son capaces de proteger a las neuronas frente a diversas situaciones de daño, lo que podría tener interés para el tratamiento de episodios de daño cerebral agudo y quizás de enfermedades neurodegenerativas.

Su participación en los procesos de memoria y aprendizaje hace pensar que los cannabinoides podrían ser de utilidad en trastornos como la extinción de memorias aversivas en situaciones de estrés post-traumático.
Análogamente, la presencia de receptores de cannabinoides en regiones del sistema límbico y el hipotálamo anterior permitiría que en este caso el bloqueo de dichos receptores pueda ser una aproximación farmacológicamente relevante en el tratamiento de trastornos alimentarios y metabólicos y de fenómenos compulsivos relacionados con la adicción a drogas.
A pesar de todo ello, la utilización clínica de los cannabinoides y otros compuestos que afectan a la señalización cannabinérgica es hoy en día bastante restrictiva.
En la actualidad se permite en algunos países la prescripción de cápsulas de THC (Marinol®) y del cannabinoide sintético nabilona (Cesamet®), así como la dispensa de marihuana medicinal, para inhibir la nausea y el vómito y estimular el apetito en pacientes de sida o cáncer tratados con agentes quimioterapéuticos emetógenos.
Entre otros posibles usos de los cannabinoides, cuyo estudio se encuentra en su mayoría en fase III de ensayos clínicos, podríamos destacar el tratamiento del dolor (el Sativex®, un aerosol oro-mucosal que contiene THC y cannabidiol, ha sido registrado recientemente en Canadá para el tratamiento del dolor neuropático asociado a la esclerosis múltiple y el dolor oncológico resistente a opioides), la atenuación de los trastornos del movimiento (espasmos y temblores) asociados a la esclerosis múltiple y la recuperación neurológica posterior a un traumatismo craneal.
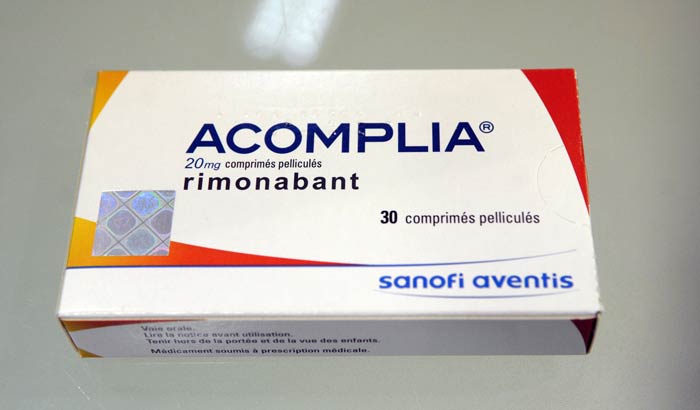
Por otro lado, un antagonista selectivo de los receptores CB1 (Acomplia®) ha sido aprobado en la Unión Europea como tratamiento adyuvante (junto con la dieta y el ejercicio físico) de la obesidad. En la Figura 8 se detallan los medicamentos hoy en día disponibles basados en cannabinoides y el estado de las principales investigaciones clínicas sobre estos compuestos.
No debemos olvidar en cualquier caso que, aunque los cannabinoides sean sustancias bastante seguras en el contexto de su aplicación clínica, su uso médico está en parte dificultado por sus efectos psicoactivos no deseados, entre los que se incluyen los de tipo afectivo (euforia), somático (somnolencia, descoordinación motora), sensorial (alteraciones en la percepción temporal y espacial, desorientación) y cognitivo (lapsos de memoria, confusión).
Aunque dichos efectos secundarios puedan ser transitorios y estar dentro de los márgenes aceptados para otros medicamentos, está claro que al menos para determinados pacientes y patologías sería deseable diseñar cannabinoides que carecieran de acciones psicotrópicas.
Puesto que éstas dependen de los receptores CB1 centrales, la opción más lógica es evitar la activación de dichos receptores (siempre que la patología en cuestión lo haga viable).
Así, se está intentando diseñar compuestos que se unan selectivamente al receptor CB2 o compuestos que no atraviesen la barrera hematoencefálica y por tanto no alcancen el sistema nervioso central.
Por otro lado, la administración a animales de experimentación de inhibidores de la degradación (recaptura o hidrólisis intracelular) de endocannabinoides ha permitido conseguir la elevación de los niveles de estos compuestos en contextos espacio-temporales restringidos y de esta manera la inducción de efectos bradiquinésicos, ansiolíticos o analgésicos sin efectos secundarios notorios. Este tipo de compuestos no ha sido aún objeto de ensayos clínicos.
La comunidad científica se encuentra hoy en día en un punto en el cual se ha acumulado un conocimiento relativamente bueno de cómo actúan molecularmente los (endo)cannabinoides en el organismo y de cuáles pueden ser algunas de sus aplicaciones terapéuticas más inmediatas. Sin embargo, es necesario llevar a cabo investigación básica más profunda.
Papel neuromodulador de la anandamida
 La ocupación de receptores postsinápticos de diversos neurotransmisores (NT), particularmente receptores ionotrópicos (iR) de glutamato, eleva la concentración citoplasmática de Ca2+ libre, lo cual induce (i) la activación de Naciltransferasas que generan precursores fosfolipídicos de anandamida (AEA) como la Nacilfosfatidiletanolamina (NAPE) y (ii) la subsecuente hidrólisis de NAPE por diversas lipasas, entre las que destaca una fosfolipasa D (PLD) de NAPE. Se ha descrito así mismo la localización presináptica de la NAPE-PLD, lo que implicaría la posible generación presináptica de AEA (señalada con interrogación).
La ocupación de receptores postsinápticos de diversos neurotransmisores (NT), particularmente receptores ionotrópicos (iR) de glutamato, eleva la concentración citoplasmática de Ca2+ libre, lo cual induce (i) la activación de Naciltransferasas que generan precursores fosfolipídicos de anandamida (AEA) como la Nacilfosfatidiletanolamina (NAPE) y (ii) la subsecuente hidrólisis de NAPE por diversas lipasas, entre las que destaca una fosfolipasa D (PLD) de NAPE. Se ha descrito así mismo la localización presináptica de la NAPE-PLD, lo que implicaría la posible generación presináptica de AEA (señalada con interrogación).
La AEA actúa sobre receptores CB1 presinápticos, que están acoplados al cierre de canales de Ca2+ sensibles a potencial y a la apertura de canales rectificadores de K+. Ello hiperpolariza la membrana plasmática e inhibe la secreción de NTs.
 La acción de la AEA finaliza mediante la recaptura por un sistema de transporte de membrana (T) aún no completamente caracterizado y una familia de enzimas intracelulares entre las que destaca la amidohidrolasa de ácidos grasos (fatty acid amide hydrolase, FAAH), de localización preferentemente postsináptica y que degrada la AEA a ácido araquidónico y etanolamina, y ensayos clínicos más exhaustivos para comprender más sólidamente la función biológica y relevancia terapéutica de estos nuevos mensajeros químicos de nuestro organismo.
La acción de la AEA finaliza mediante la recaptura por un sistema de transporte de membrana (T) aún no completamente caracterizado y una familia de enzimas intracelulares entre las que destaca la amidohidrolasa de ácidos grasos (fatty acid amide hydrolase, FAAH), de localización preferentemente postsináptica y que degrada la AEA a ácido araquidónico y etanolamina, y ensayos clínicos más exhaustivos para comprender más sólidamente la función biológica y relevancia terapéutica de estos nuevos mensajeros químicos de nuestro organismo.
Este artículo es un extracto parcial del estudio “Endocannabinoides: un nuevo sistema de comunicación en el cerebro”, del profesor Dr. Manuel Guzmán y del profesor Dr. Ismael Galve-Roperh, realizado por Deméter – Centro de Conservación Genética de Cannabis sativa L. y subespecies (http://www.demeter.org.es).
Muchos años luchando en la sombra para que el cannabis florezca al sol.














